L’atome d’oxygène possède 6 électrons périphériques. Sa valence est égale à 2. L’hydrogène possède un électron périphérique et établit une liaison de covalence.
Structure de la molécule d’eau
La présence de deux doublets non liants sur l’atome d’oxygène donne à l’eau une structure tétraédrique. La géométrie de la molécule d’eau est donc coudée. Les études spectroscopiques montrent que l’angle H-Ô-H est de 104,5°. L’oxygène étant beaucoup plus électronégatif que l’hydrogène, le doublet d’électrons de chaque liaison O-H se déplace donc vers l’atome d’oxygène. Cela se traduit par un excédent de charges négatives sur l’atome d’oxygène et un déficit de charges positives sur l’atome d’hydrogène. Du fait de sa géométrie coudée, le barycentre des charges partielles positives ne coïncide pas avec celui des charges partielles négatives. La molécule d’eau est donc polaire. Elle constitue un dipôle électrique permanent, ce qui explique qu’elle soit un bon solvant pour les électrolytes solides, liquides ou gazeux (ex : pour les molécules polaires comme HCl ou pour les solides ioniques cristallins comme le sel). En effet, l’eau peut dissoudre tous les solides ioniques cristallins, c’est pourquoi elle intervient dans de nombreux phénomènes géologiques et physiologiques.

Représentation de la structure de la molécule d’eau
L’eau est un composé thermiquement stable. A partir de 3000°C, elle peut se dissocier selon l’équation : H2O → H2 + 1/2 O2. C’est une transformation endothermique. La vapeur d’eau peut-être dissociée par le rayonnement UV solaire dans les couches supérieures de l’atmosphère terrestre (1/2 vie de 36 h).
La transformation inverse qui correspond à la synthèse de l’eau : H2 + 1/2 O2 → H2O est un mécanisme complexe qui se déroule en plusieurs phases avec formation de radicaux.
Cet ensemble de réactions chimiques conduisant à la molécule d’eau à partir des atomes O et H est très exothermique. C’est ce qui rend possible la formation de l’eau dans le milieu interstellaire, à basse température.
Les températures de changement d’état de l’eau (fusion, ébullition) sont élevées et servent de référence dans le système proposé par Celsius. A la pression atmosphérique : Tfusion = 0°C et Tébullition= 100°C. 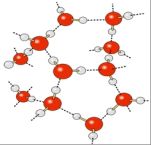
Cela témoigne d’un milieu où les molécules sont très associées. En effet, il existe dans l’eau liquide et dans la glace des liaisons intermoléculaires de type électrostatique : les liaisons hydrogène. Il s’agit de liaisons impliquant l’atome d’hydrogène d’une molécule et le doublet non liant de l’atome d’oxygène d’une autre molécule. Ces liaisons sont assez difficiles à briser et confèrent donc une grande stabilité physique à ces deux phases de l’eau.
A quantité de matière égale, la glace occupe un plus grand volume que l’eau liquide. Cela est dû aux liaisons H. En établissant ses liaisons, les molécules d’eau adoptent une disposition spatiale qui conduit à une structure peu compacte pour la glace et à un comportement très particulier : la glace étant moins dense que l’eau liquide, la glace flotte sur l’eau.
Le diagramme de phase de l’eau illustre les domaines de température et de pression où l’eau se trouve à l’état gazeux, liquide et solide.
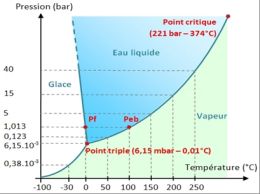
Diagramme de phases
Il montre que le point triple correspond à une température de 0,01°C et une pression de 6,15.10-3 bar. En dessous du point triple, l’eau ne peut pas exister sous forme liquide. La courbe de changement de phase liquide-vapeur (appelée courbe de vaporisation) est limitée supérieurement en un point appelé point critique. Au delà de ce point, l’eau devient un fluide supercritique qui possède la propriété de dissoudre des substances insolubles dans l’eau en dessous du point critique. La lecture de ce diagramme permet de comprendre les raisons pour lesquelles on retrouve essentiellement de l’eau sous forme de glace et de vapeur dans le cosmos. A basse pression, et à basse température, l’eau interstellaire est présente sous forme de vapeur ou de glace amorphe. En effet, selon la température et la pression, la glace d’eau peut présenter différents types de structure cristalline (hexagonal, cubique).
Sur Terre, elle se présente sous la forme d’un réseau hexagonal.
A la lecture du diagramme, on peut espérer trouver de l’eau liquide si les conditions suivantes sont réunies :
– température comprise entre 0 et 130 °C pour des pressions comprises entre 6,15.10-3 et 2 bars : c’est le domaine des planètes telluriques et des exo-planètes de type tellurique.
– à haute température et haute pression : c’est le domaine interne des satellites des planètes géantes, comme Titan.